 期刊:Experimental & Molecular Medicine
期刊:Experimental & Molecular Medicine
影响因子:12.9
主要技术:scRNA-seq、Visum
摘要
食管鳞状细胞癌(ESCC)患者常因淋巴结转移而面临严峻预后。然而,关于ESCC转移性淋巴结的细胞和分子特性的全面理解仍然难以实现。在这项涉及12名转移性ESCC患者的研究中,我们采用了单细胞测序、空间转录组学(ST)和多重免疫组化学(mIHC)技术,探索原发肿瘤样本、邻近组织、转移性和非转移性淋巴结的空间和分子属性。对161333个细胞的分析显示,上皮细胞中有特定亚簇在转移性淋巴结中显著富集,表明具有促转移特性。此外,肿瘤微环境中的间质细胞,包括MMP3+IL24+成纤维细胞、APLN+内皮细胞和CXCL12+周细胞,也被认为通过血管生成、胶原蛋白生成和炎症反应参与ESCC转移。处于循环状态的CD8+ T细胞在转移性淋巴结中尤为常见,表明其在促进转移中具有潜在作用。我们识别出不同的细胞间通信网络和特定的配体-受体通路。我们的发现通过空间转录组图谱和mIHC得到了验证。本研究加深了我们对ESCC患者转移性淋巴结细胞和分子层面的理解,为这些患者提供潜在的新治疗策略见解。
主要技术
scRNA-seq、Visum
研究结果
1.通过scRNA测序和空间转录组学揭示的ESCC表征
为全面阐明ESCC的细胞特性,我们对12名ESCC患者通过手术获得的29个样本进行了scRNA-seq分析,包括12个肿瘤样本、6个邻近正常组织、4个转移性淋巴结和7个非转移性淋巴结(图1a)。共计对161333个高质量细胞进行了以下分析,其中61928个细胞来自肿瘤样本,29518个来自邻近正常组织的细胞,49966个来自淋巴结的细胞,以及19921个来自转移性淋巴结的细胞。根据已知标志物鉴定了12种主要细胞类型(图1b,c),包括T细胞、B细胞、浆细胞、肥大细胞、巨噬细胞、单核细胞、树突状细胞、中性粒细胞、周细胞、成纤维细胞、上皮细胞和内皮细胞。此外,我们的结果显示,T细胞的分数和B细胞在淋巴结中的比例远高于其他样本,而转移性淋巴结中上皮细胞的比例最高(图1d)。此外,利用一名转移性ESCC患者的肿瘤样本,揭示了ESCC的空间转录组特征,并在ST切片上标注了每种主要细胞类型(图1e)。总体而言,我们揭示了ESCC组织的细胞组成和空间特征,便于后续对转移相关细胞亚群的分析。
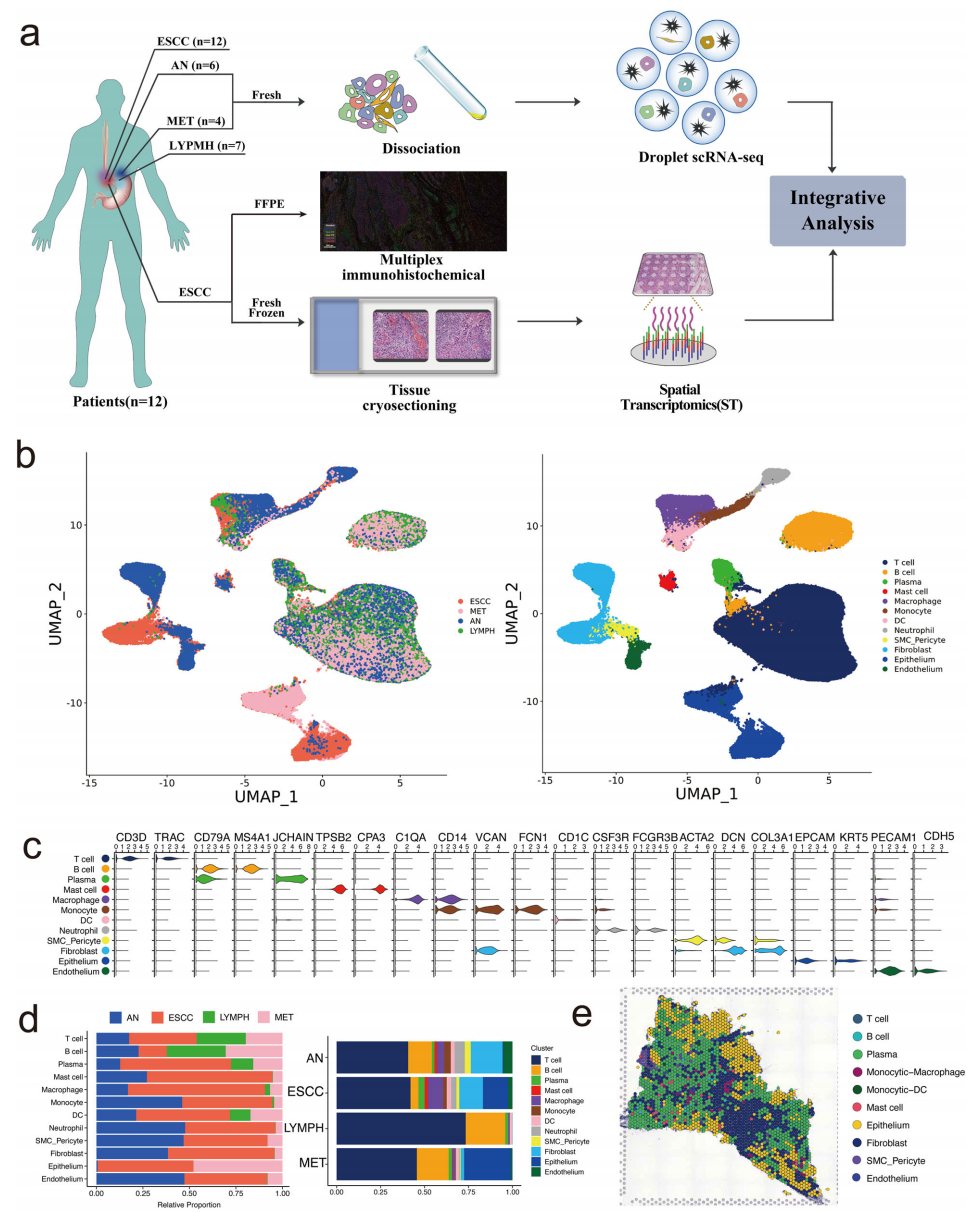
图1
2.转移性ESCC中具有促进转移特征的上皮细胞
从肿瘤样本、正常组织和转移性淋巴结中识别出16416个恶性上皮细胞。共分类了3个上皮细胞亚簇,其中大多数起源于肿瘤样本和转移性淋巴结(图2a,b)。大多数来自邻近组织的上皮细胞为ME1亚簇,表明ME1亚簇的恶性潜力相对较低。ME2和 ME3亚簇主要从肿瘤样本和转移性淋巴结中采集,表明ME2和ME3亚簇可能具有较高转移潜力。与邻近组织获得的上皮细胞相比,转移性淋巴结获得的上皮细胞CNV评分远高于此(图2c)。每个亚簇的关键标记基因如图2d。此外,我们的发现显示ME1亚群在三个亚群中恶性评分最低,非恶性分数最高,这意味着ME1亚群的恶性潜能较低(图2f)。我们评估了这些基因在上皮细胞中的表达水平,这些基因来自ESCC、邻近组织和转移性淋巴结,随后选择了在转移性淋巴结中高度表达的基因作为促转移基因(图2e)。与转移性淋巴结的功能相比,显示原发肿瘤的药物代谢和耐药性高度富集(图2g)。在组织学层面,肿瘤区域在H&E图像和ST特征图中确定(图2h)。根据促转移特征,识别出特定的转移相关区域,并在转移相关区域周围发现血管,表明新血管的招募可能是ESCC转移的关键。mIHC图像显示,上皮细胞的标记基因(EPCAM、DSP和TXNRD1)在肿瘤区域,尤其是转移相关区域高度表达(图2i)。通过空间分析和mIHC验证了所选基因,上述结果显示TXNRD1在促转移区域高度表达。
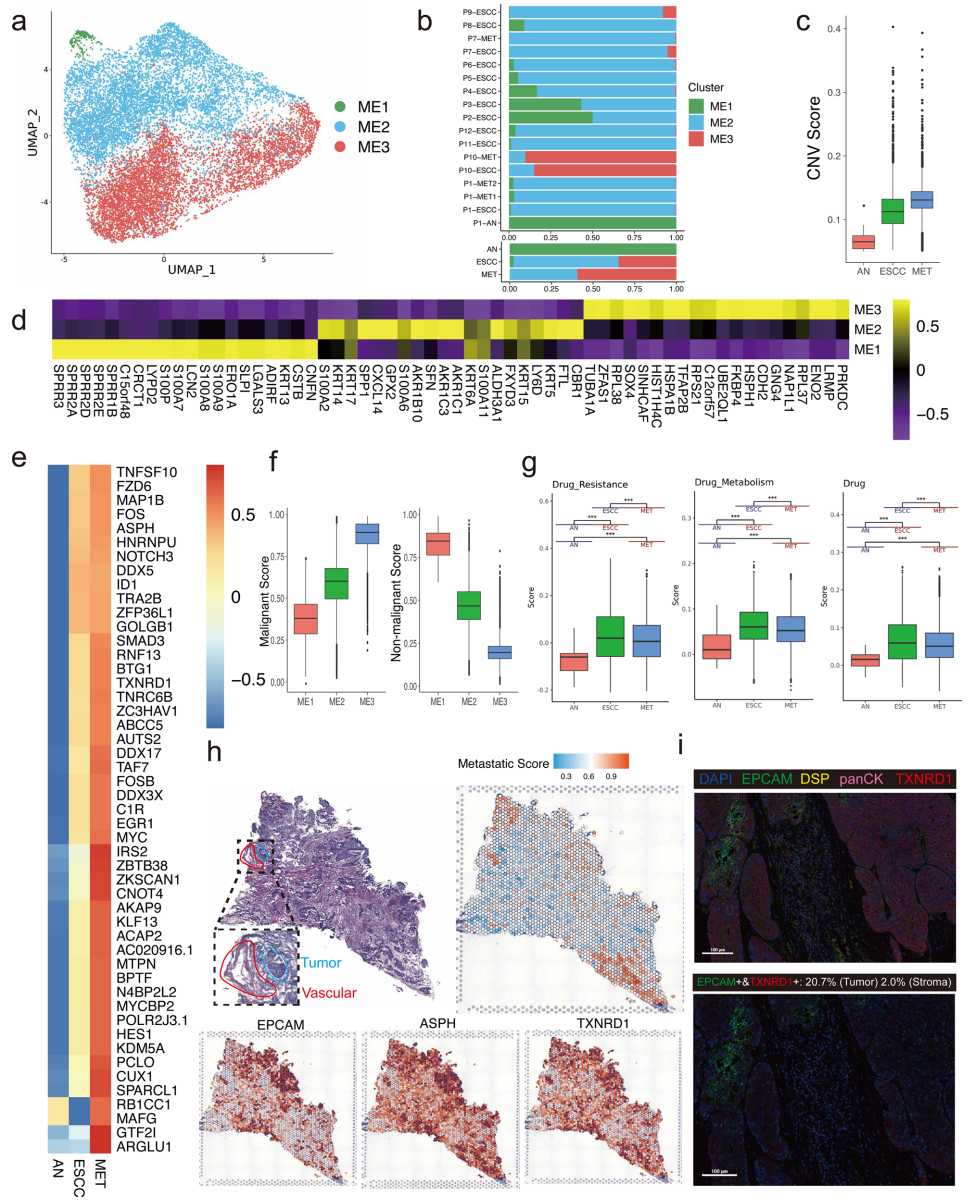
图2
3.mCAF1(MMP3+IL24+)通过降解细胞外基质促进血管新生,促进了ESCC转移
细胞外基质(ECM)在塑造癌症进展和促进转移中发挥显著作用。随后,我们研究了癌症相关成纤维细胞(CAFs)的亚群。根据先前的研究,我们将14248个CAFs归为两个主要亚群:iCAF和mCAF(图3a)。iCAF亚簇主要富含生长因子,包括WNT和NF-kB通路(SFRP1和NFKBIZ),以及一些趋化因子标记(CXCL1和CCL2),而mCAF亚簇则显著积累了POSTN基因(图3b)。随后共识别出四个mCAF亚簇和六个iCAF亚簇,并发现不同亚簇的表达谱(图3b)。
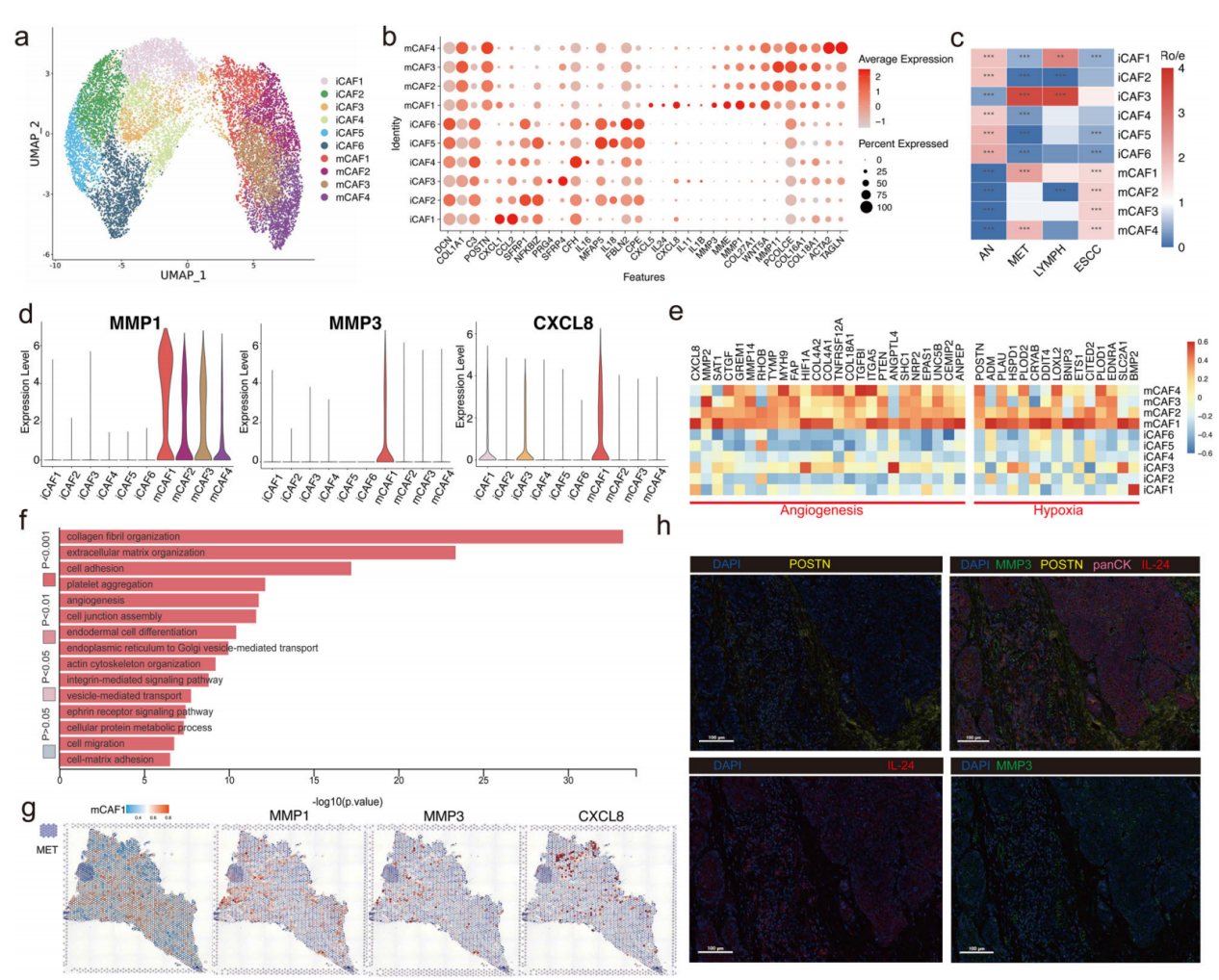
图3
一些CAF亚簇同时富集于转移性淋巴结和原发肿瘤部位,如mCAF1(MMP3+IL24+)和mCAF4,表明这些亚簇可能在促进ESCC转移中发挥关键作用(图3c)。为进一步探讨这些CAF亚簇如何促进转移,我们发现mCAF1中MMP1和MMP3的表达水平显著高于其他亚群(图3d)。MMP3可能降解基底膜和ECM,为肿瘤发生和转移提供条件。与MMP3的功能类似,p53的功能障碍可能提高MMP1表达,进而加剧肺腺癌的转移。CXCL8的表达水平在mCAF1中也明显高于其他亚簇。此外,我们发现抗血管生成基因(如HIF1A)和缺氧相关基因(如ADM)在mCAF1中表达较高(图3e)。功能分析还显示血管生成主要富含mCAF1(图3f)。通过ST和mIHC验证了mCAF1区域及相关标记基因,样本取自转移性ESCC,显示mCAF1在TME的间质区中富集(图3g,h)。mCAF1亚簇也包围了ST特征图中的促转移区域,表明mCAF1亚簇参与了ESCC转移(图3g)。本研究提出,mCAF1促进的肿瘤微环境中ECM和血管生成的降解可能促成ESCC转移。
4.SOX4和SOX11通过再生血管生成和胶原蛋白生成驱动APLN+内皮细胞趋向促进转移表型
内皮细胞是ECM的重要组成部分。3325个内皮细胞分为4个簇,包括1个动脉内皮细胞(AEC)亚簇、2个毛细血管内皮细胞(CEC)亚簇、4个血管内皮细胞(VEC)亚簇和1个淋巴内皮细胞(LEC)亚簇(图4a)。我们的发现显示,CEC亚簇中积累了与毛细血管功能(如RGCC和PLVAP)相关的基因(图4b)。我们发现CEC亚群,尤其是CEC2,在原发肿瘤样本和转移性淋巴结中占优,表明CEC2可能在ESCC转移中起关键作用(图4c)。
为了进一步探讨CEC2在转移性ESCC中的作用,我们发现APLN和APLNR在CEC2(又称APLN+内皮细胞)中表达较高(图4d)。APLN通常被视为与再生血管生成相关的重要生物标志物,可能使内皮细胞从成熟状态转变为增殖状态。此外,COL4A1和COL4A2在CEC亚簇中表达较高,尤其是在APLN+内皮细胞中,表明这些亚簇在生成胶原蛋白中起着重要作用(图4c)。胶原蛋白粘连是癌症侵袭和转移过程中发生的复杂机制,这可能是APLN+内皮细胞的潜在功能。此外,COL4A1还可能激活FAK-Src信号通路,进而促进癌症进展和转移。
随后,我们进行了SCENIC检测APLN+内皮细胞的上游转录因子,这些因子可能驱动APLN+内皮细胞形成促转移表型。SOX4和SOX11是APLN+内皮细胞中上调最显著的转录因子之一(图4f)。SOX4主要与胶原蛋白生成相关(如CXCR4、COL4A1和COL4A2),而SOX11调控与再生血管生成相关的基因(RGCC和APLN),进一步促进了内皮细胞向TME促转移表型的分化(图4e)。通过mIHC图验证了SOX4和SOX11的调控网络(图4g)。此外,ST特征图和解卷积分析结果显示,APLN+内皮细胞环绕着肿瘤细胞的促转移区域,关键标志基因的表达水平高度表达(图4h-i)。mIHC图被用来进一步验证结果,显示了ESCC中APLN+内皮细胞的促转移特性(图4j)。
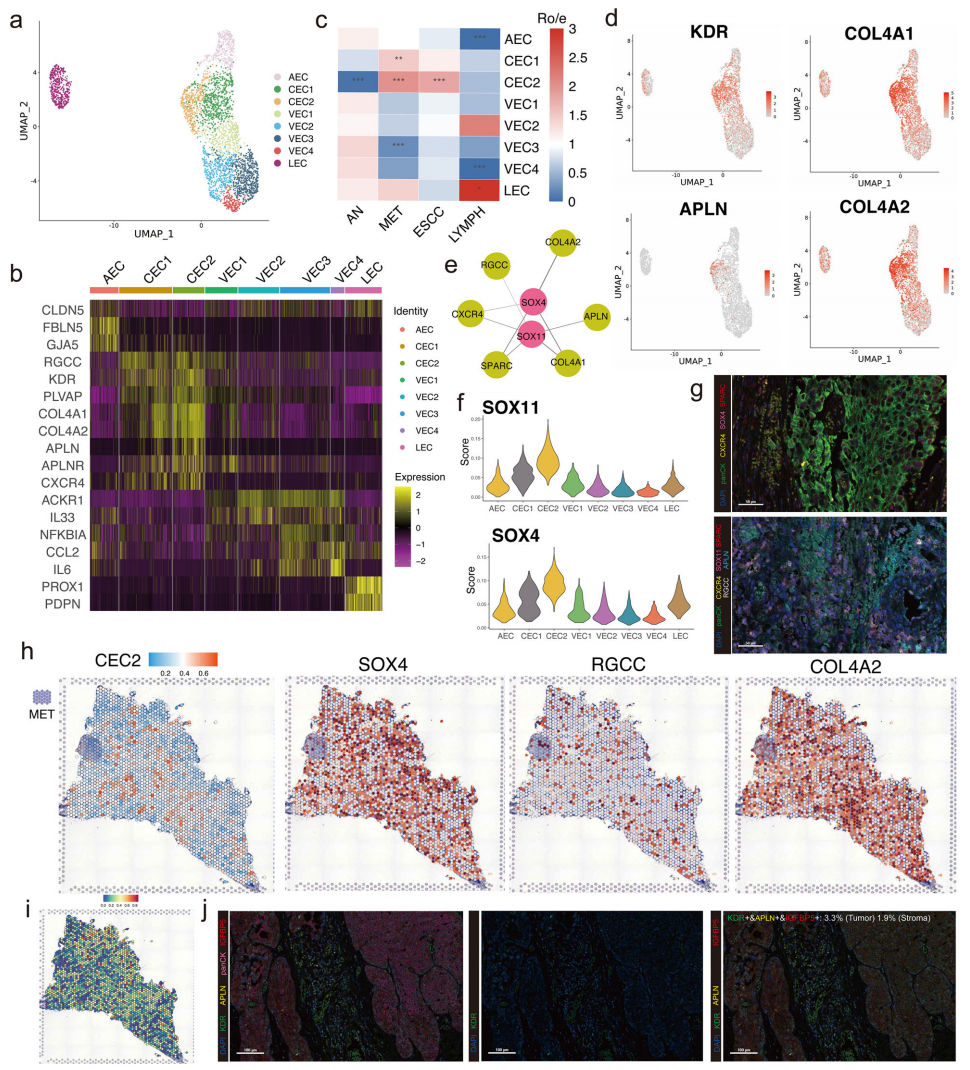
图4
5.由平滑肌细胞形成的不连续血管和由PC1(CXCL12+)激活的炎症反应促进ESCC转移
ESCC共将2191个细胞分为4个PC亚群和5个SMC亚群(图5a)。大多数SMC亚簇在转移性淋巴结中的比例显著减少,以PC1亚簇为主(图5b)。SMCs是血管的关键组成部分,对于细胞周,转移性淋巴结中PC1的比例显著较高,暗示PC1亚簇在ESCC转移中可能起作用(图5c)。我们的发现显示,CXCL12在PC1亚簇中表达较高,表明PC1可能激活转移性ESCC中的特定炎症通路(图5c,d)。接着,我们识别出一些在PC1亚簇中显著富集的通路,如IL-17信号通路、NF-κB信号通路和TNF信通路(图5e)。使用ST特征图、mIHC图以及去卷积分析结果验证(图5f–h)。
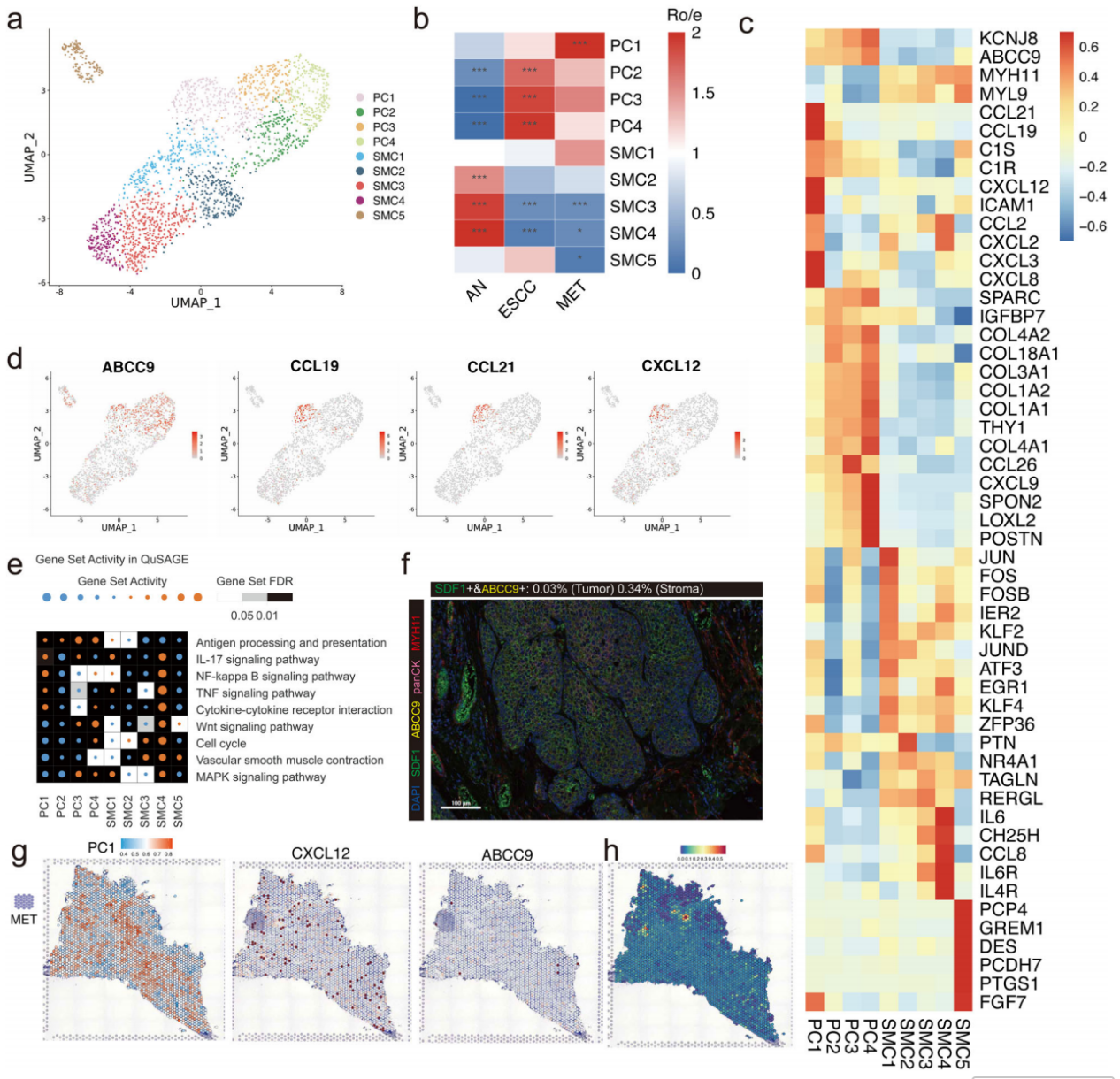
图5
6.处于循环状态的耗尽CD8+ T细胞可能是促转移肿瘤微环境的重要组成部分
识别并分类了25816个CD8+ T细胞,分为六个亚簇(图6a)。循环和耗尽的CD8+ T细胞在肿瘤样本和转移性淋巴结中相对丰富(图6b)。我们将耗尽的CD8+ T细胞(CD8-TEX)分为两个亚组,正常状态的CD8+ T细胞(CXCL13+MKI67-)和循环状态的CD8+ T细胞(CXCL13+MKI67+)(图6c)。为了进一步探讨转移性ESCC中CD8+ T细胞的动态过渡过程,构建了CD8+ T细胞状态轨迹的拟时间图谱。该轨迹以初生CD8+ T细胞(CD8-TN)、中央记忆CD8+ T细胞(CD8-TCM)、效应记忆CD8+ T细胞(CD8-TEM)和效应CD8+ T细胞(CD8-TEMRA-TEFF)为CD8-TN与CD8-TEF之间的过渡状态,最终达到循环-CD8-TEX的最终分化状态(图6d)。我们评估了每个CD8+ T细胞亚簇的耗尽水平,表明Cycling-CD8-TEX和CD8-TEX得分最高(图6e)。免疫检查点抑制剂(ICI)被认为是癌症治疗的重要靶点,其中一些抑制性受体与T细胞耗尽相关。我们分析了5个ICI在不同CD8+ T细胞亚簇中的表达水平,发现ICI在Cycling-CD8-TEX和CD8-TEX中表达较高,表明这两个亚群的耗尽状态(图6f)。为了进一步探讨淋巴结转移的独特细胞相互作用,我们分析了正常和转移淋巴结中的细胞间差异性通讯(图6g)。与正常淋巴结相比,CD70-CD27和IL4-IL4R相互作用被显著识别,这些相互作用可能激活CD8-TEX,进而抑制肿瘤微环境。
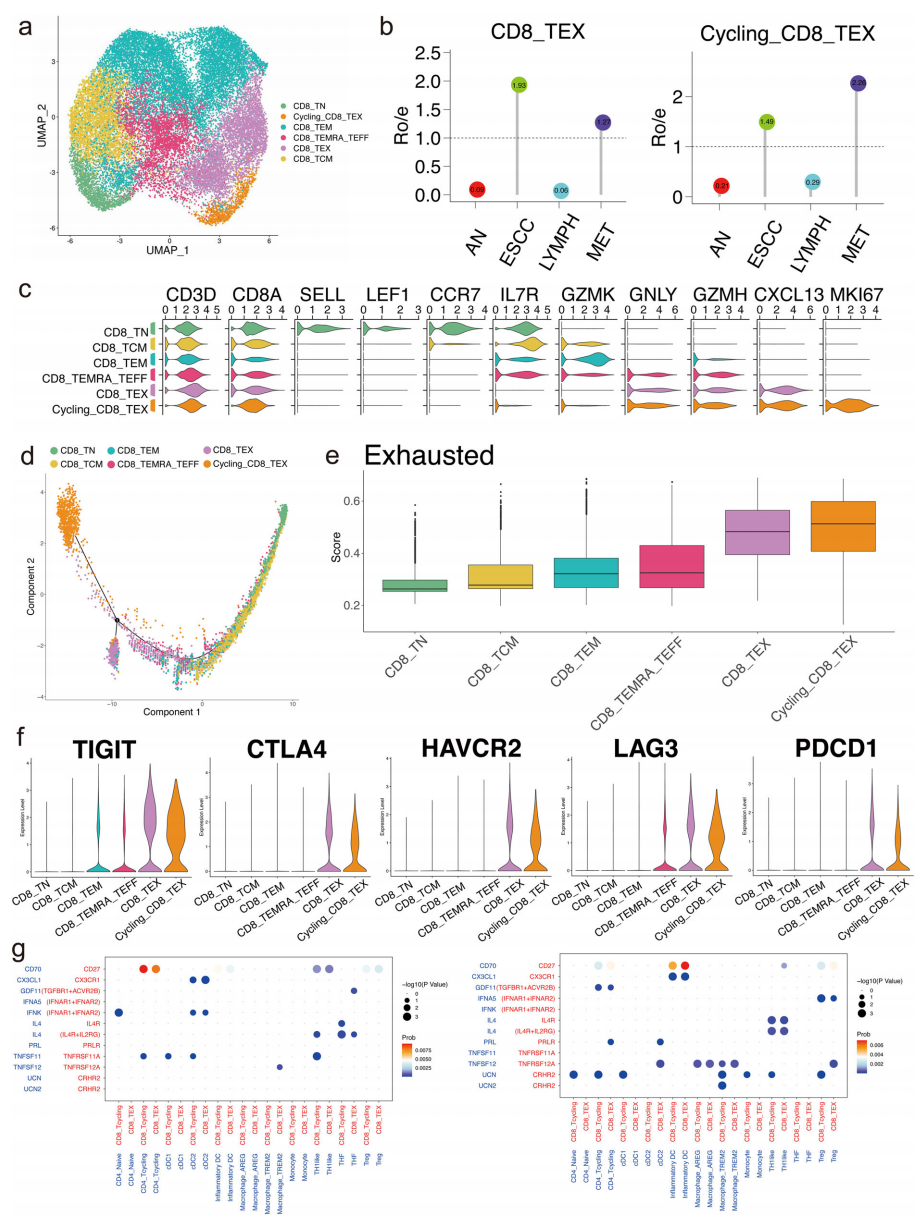
图6
结论
最新研究已证明ESCC免疫细胞的独特特征。然而,尚未对ESCC中转移性和非转移性淋巴结的单细胞层面微环境进行深入研究。本研究中,我们使用了来自12名ESCC患者的29份样本,包括肿瘤样本、邻近正常组织、转移性和非转移性淋巴结,全面展示了转移性ESCC在单细胞层面微环境中的细胞和分子特征。我们构建了空间转录组图谱,并利用mIHC图像进一步探讨ESCC转移机制,验证了scRNA-seq的发现。scRNA-seq和ST的整合为开发和应用转移性ESCC的新治疗策略奠定了基础。
由于转移仍是癌症预防和治疗中的重大挑战,揭示TME的细胞和分子特性对于了解ESCC淋巴结转移情况至关重要。鉴于肿瘤细胞的固有异质性,识别与转移相关的独特上皮细胞亚群的任务极具挑战性。以往研究已识别出促进肿瘤转移的特定上皮细胞亚簇,而在ESCC15,43中尚未发现促进转移的关键亚簇。根据我们的研究,表现出促转移特征的上皮细胞在转移性淋巴结中数量丰富,这些淋巴结在ESCC中可能具有显著的转移潜力。我们的研究结果还显示,转移性淋巴结的耐药性和药物代谢功能并未显著富集,表明这些上皮细胞亚群具有促进转移的特性。在组织学层面,我们已根据促转移特征识别出转移相关区域。值得注意的是,观察到这些特定区域周围有血管,表明新血管的招募可能在ESCC转移中起关键作用。
总之,我们提供了关于ESCC转移中涉及的空间模式和不同细胞成分的独特视角和关键信息。我们已鉴定出在ESCC中表现出促进转移特性的特定上皮细胞,这些细胞可能成为转移的主要起始因子。此外,需要更多关注间质细胞,包括成纤维细胞、内皮细胞、平滑肌细胞和周围细胞,因为它们可能通过调节血管生成和影响细胞外基质的形成,在促进转移中发挥关键作用。此外,最近发现肿瘤微环境中的多种免疫细胞积极促进ESCC转移。最近发现的促转移细胞成分以及肿瘤微环境中独特的细胞间通讯,将对开发转移性ESCC的有效治疗策略至关重要。
参考文献:
Guo W, Zhou B, Dou L, Guo L, Li Y, Qin J, Wang Z, Huai Q, Xue X, Li Y, Ying J, Xue Q, Gao S, He J. Single-cell RNA sequencing and spatial transcriptomics of esophageal squamous cell carcinoma with lymph node metastases. Exp Mol Med. 2025 Feb;57(1):59-71. doi: 10.1038/s12276-024-01369-x. Epub 2025 Jan 1. PMID: 39741182; PMCID: PMC11799171.
