肥胖与胰岛素抵抗、2型糖尿病、肝脏及心血管疾病、癌症的发生发展息息相关,是全球重大公共卫生问题。肝脏中胰岛素敏感性在糖脂代谢调控中具有重要作用:正常状态下,胰岛素可以通过抑制糖原分解和糖异生并刺激糖原生成、糖酵解和脂肪生成来抑制葡萄糖生成;而在胰岛素抵抗状态下,胰岛素无法调节脂质和碳水化合物代谢就会导致高血糖和血脂异常,从而加重肝脏疾病 (非酒精性脂肪肝 (NAFLD)、非酒精性脂肪肝炎 (NASH)、肝硬化以及肝细胞癌) 的风险。除此之外,肝脏疾病又会促进糖尿病的发生发展,但其相关的分子机制仍未知。
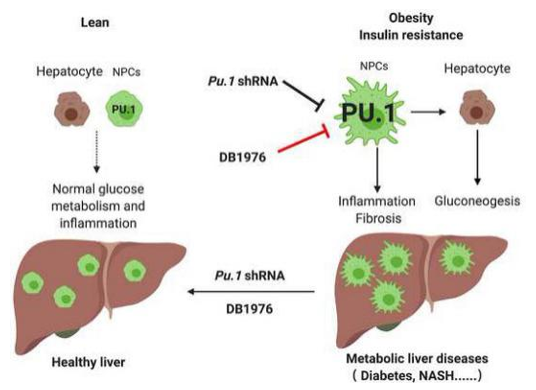
近日,哥伦比亚大学强力教授、Pajvani 教授以及贝勒医学院和国家蛋白质科学中心-北京 (凤凰中心) 的秦钧教授等利用转录因子亲和富集和LC-MS/MS的技术方法研究小鼠肝脏中导致胰岛素抵抗的内源转录因子,并证实抑制造血免疫的关键转录因子PU.1可改善代谢功能障碍和非酒精性脂肪肝炎,可作为肝功能障碍和代谢疾病新的治疗靶点,相关研究成果在Journal of Hepatology (IF= 18.946) 杂志上发表了Inhibition of PU.1 ameliorates metabolic dysfunction and non-alcoholic steatohepatitis 的研究论文。

Journal of Hepatology (IF= 18.946)
技术路线图:
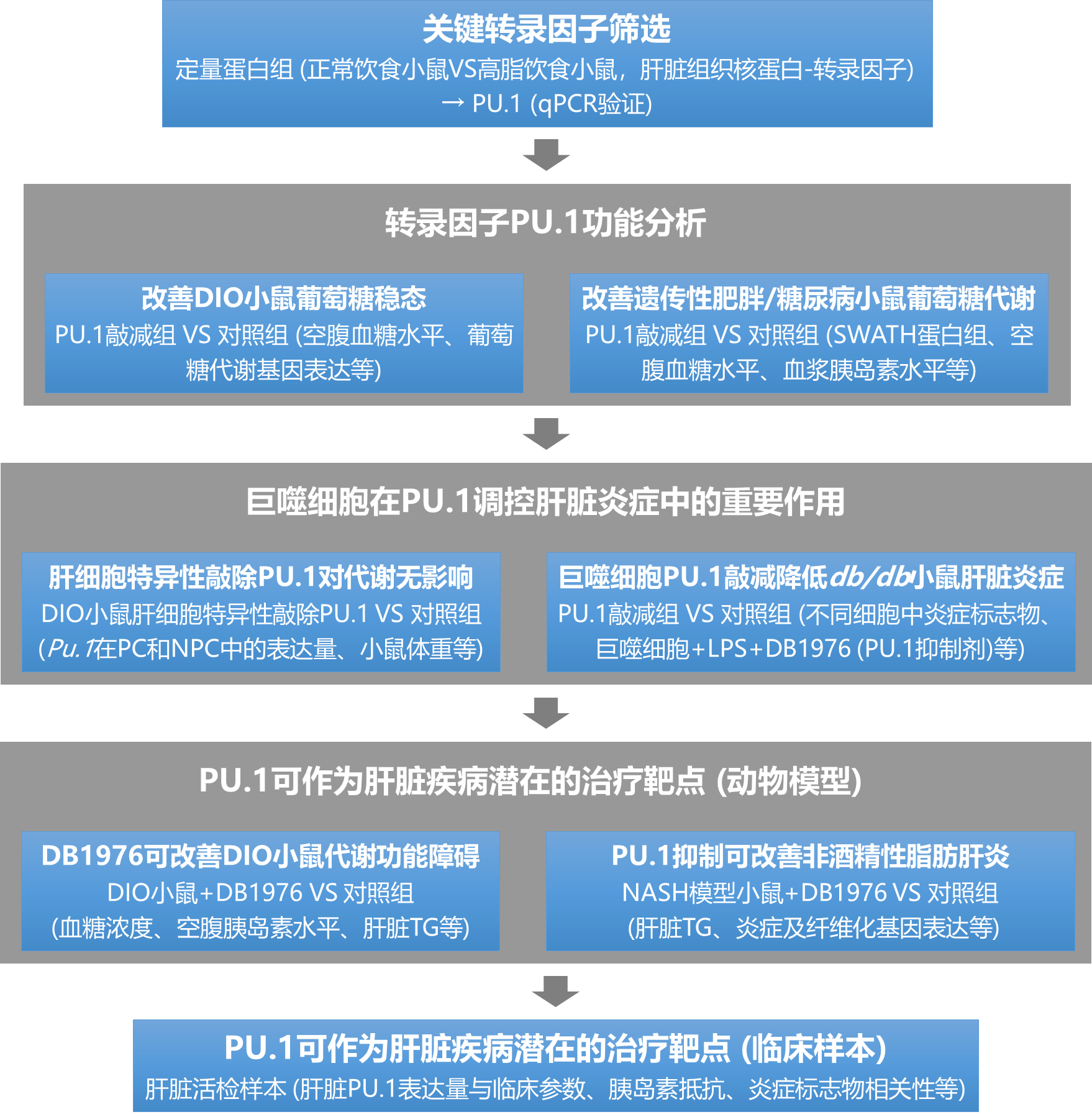
主要研究结果:
1. 肝脏PU.1在饮食诱导高脂饮食小鼠中上调
首先作者通过定量蛋白质组学技术系统性分析了可导致肥胖引起的代谢综合征的肝脏转录因子 (图1A)。基于前期开发的转录因子富集方法分析精瘦和肥胖小鼠肝脏中内源表达的转录因子,发现上调显著的为髓样细胞活性的主要调节剂PU.1/SPI1 (图1B);同时发现Pu.1在饮食诱导肥胖 (DIO) 的小鼠肝脏中上调~5倍 (图1C)。
为确定肝脏中上调PU.1来源,进一步从C57BL/6J野生型小鼠肝脏中分离得到实质细胞 (PCs) 和非实质细胞 (NPCs),结果发现尽管在DIO小鼠中肝细胞Pu.1上调约3.6倍,但Pu.1主要在NPCs细胞中表达 (主要为巨噬细胞和B细胞,图1F)。肝脏T细胞和星状细胞 (HSCs) 对DIO小鼠肝脏Pu.1表达无显著影响 (图1F-G)。因此,肥胖小鼠肝脏中PU.1增加主要来源于肝细胞Pu.1表达量及巨噬细胞数量增加。
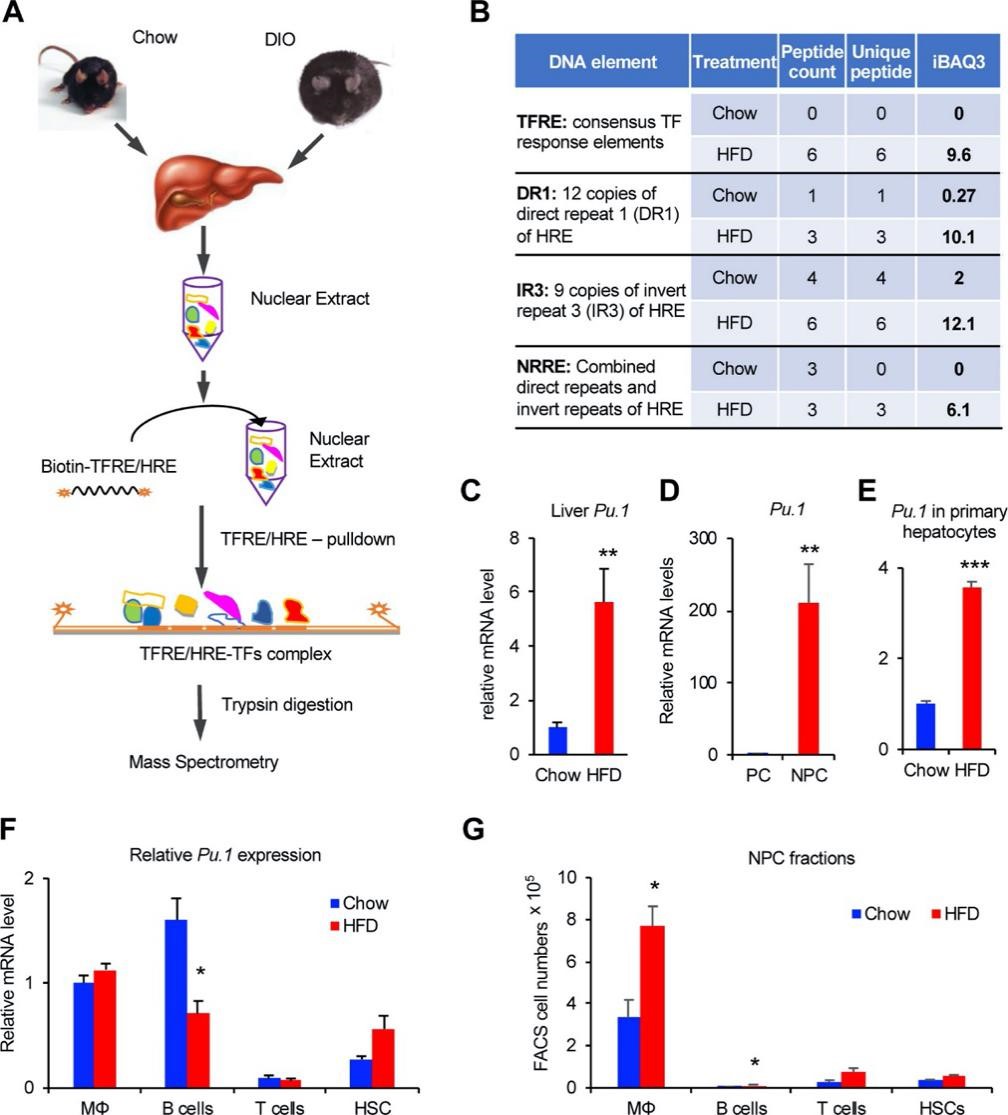
图1 转录因子PU.1在DIO小鼠肝脏中上调
2. 肝脏PU.1对遗传性/饮食引起肥胖小鼠葡萄糖稳态的调控作用
1) DIO小鼠肝脏Pu.1敲减可改善葡糖糖稳态
通过构建针对Pu.1的shRNAs进一步探索PU.1在肝脏代谢中的功能,发现Pu.1敲减不会影响小鼠体重,但会降低空腹血糖浓度、改善葡萄糖耐量并抑制糖异生关键调节因子Pck1的表达。敲减小鼠肝脏比对照组稍大,但肝脏中甘油三酯 (TG) 和胆固醇以及血浆中脂质和丙氨酸转氨酶 (ALT) 的浓度未发生显著变化,说明肝脏中PU.1敲减对脂肪组织影响较小。
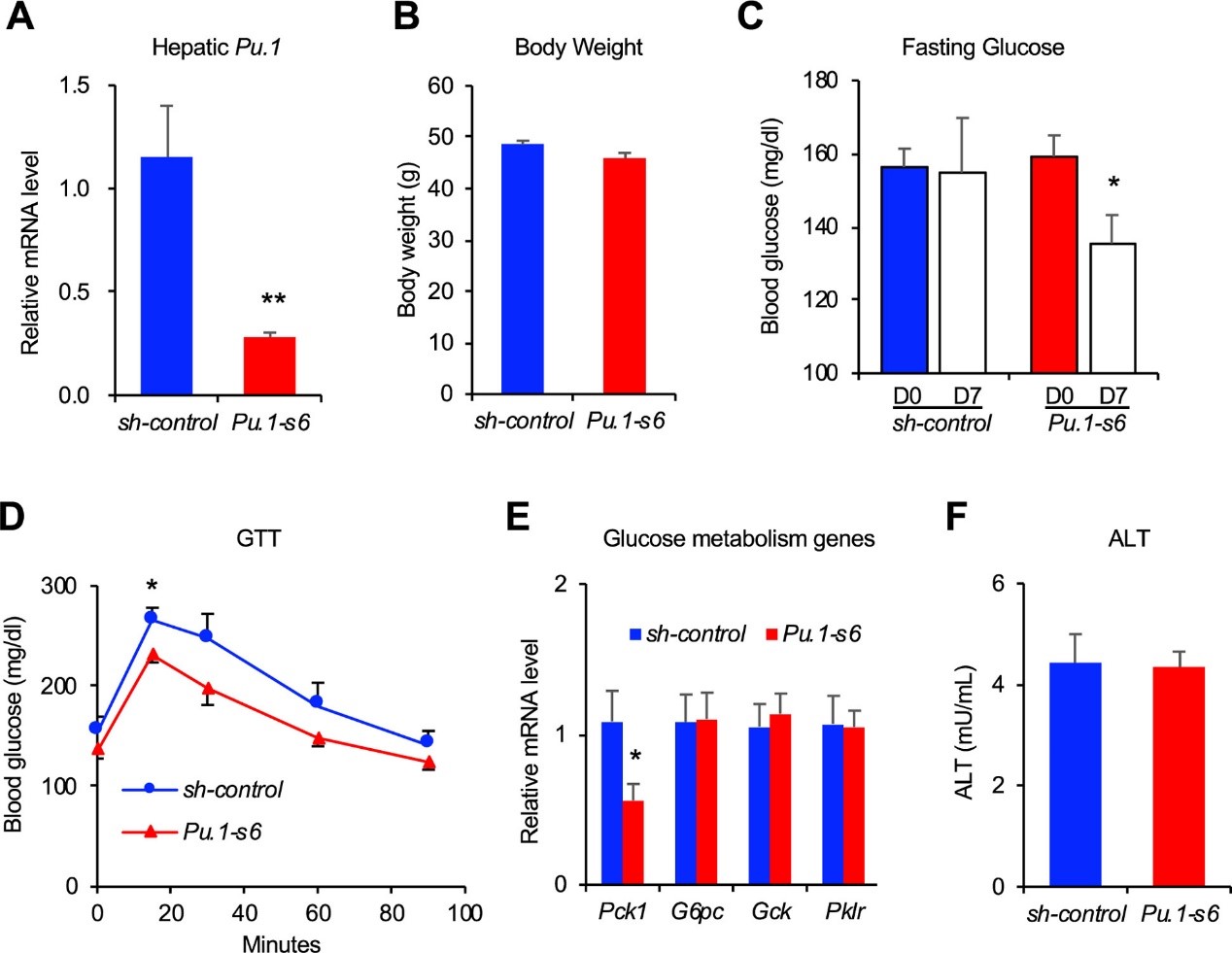
图2 Pu.1敲减改善DIO小鼠葡萄糖稳态
2) 肝脏敲减Pu.1可改善糖尿病db/db小鼠血糖控制
作者进一步在遗传性肥胖/糖尿病小鼠模型 (瘦素受体缺陷型db/db小鼠) 中研究PU.1的表达量,为了提高准确度,使用全扫描的SWATH模式对db/db小鼠肝脏中Pu.1的表达量进行分析,发现与对照组相比,在db/db小鼠肝脏组织中Pu.1的表达量显著上调,与饮食诱导的肥胖模型一致 (图3A-B),表明PU.1可能作为db/db小鼠有益的干预靶点。与前部分研究工作类似,作者发现Pu.1敲减对小鼠体重及血浆胰岛素和TG含量无显著影响,却显著降低空腹血糖浓度,改善db/db小鼠葡萄糖耐量并降低Pck1表达量 (图3C-I)。综上,肝脏PU.1是db/db小鼠和DIO小鼠葡萄糖稳态失调的重要因素。
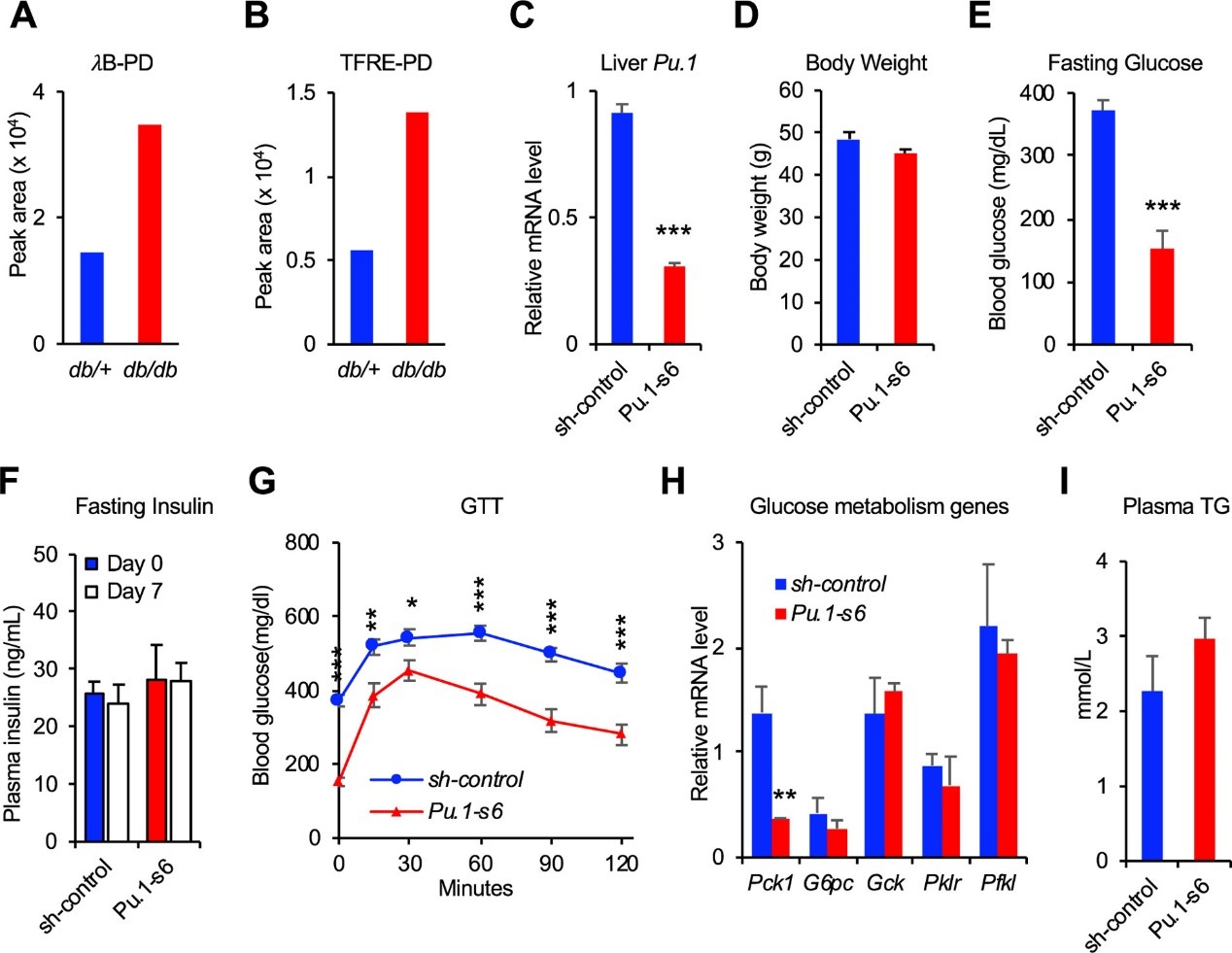
图3 Pu.1敲减改善db/db小鼠葡萄糖稳态
3、 巨噬细胞在PU.1调控肝脏炎症中的重要作用
1) 肝脏特异性敲除PU.1对葡萄糖代谢无显著影响
由于Pu.1在DIO肝细胞中显著高表达,并且肝细胞是肝脏中唯一的葡萄糖生成细胞,作者进一步解析Pu.1敲减的降糖作用是否由于肝细胞PU.1降低所致,因此构建了肝脏特异性Pu.1敲减小鼠。发现上述小鼠葡萄糖耐量未受影响,与AAV8-TBG-GFP对照组小鼠相比,高脂饮食喂养的Pu.1敲减AAV8-TBG-Cre小鼠葡萄糖耐量或胰岛素敏感性均未发生显著变化 (图4A-C)。最后将Pu.1flox/flox小鼠与Alb-Cre小鼠杂交,得到肝细胞特异性敲除PU.1 (不会影响NPC Pu.1表达,图4D-E)。高脂饮食喂养3个月后,基因敲除小鼠的体重、葡萄糖耐量以及胰岛素敏感性与对照小鼠相近 (图4F-H)。上述结果表明Pu.1敲减改善葡萄糖稳态不是由于肝细胞Pu.1基因缺失引起的。
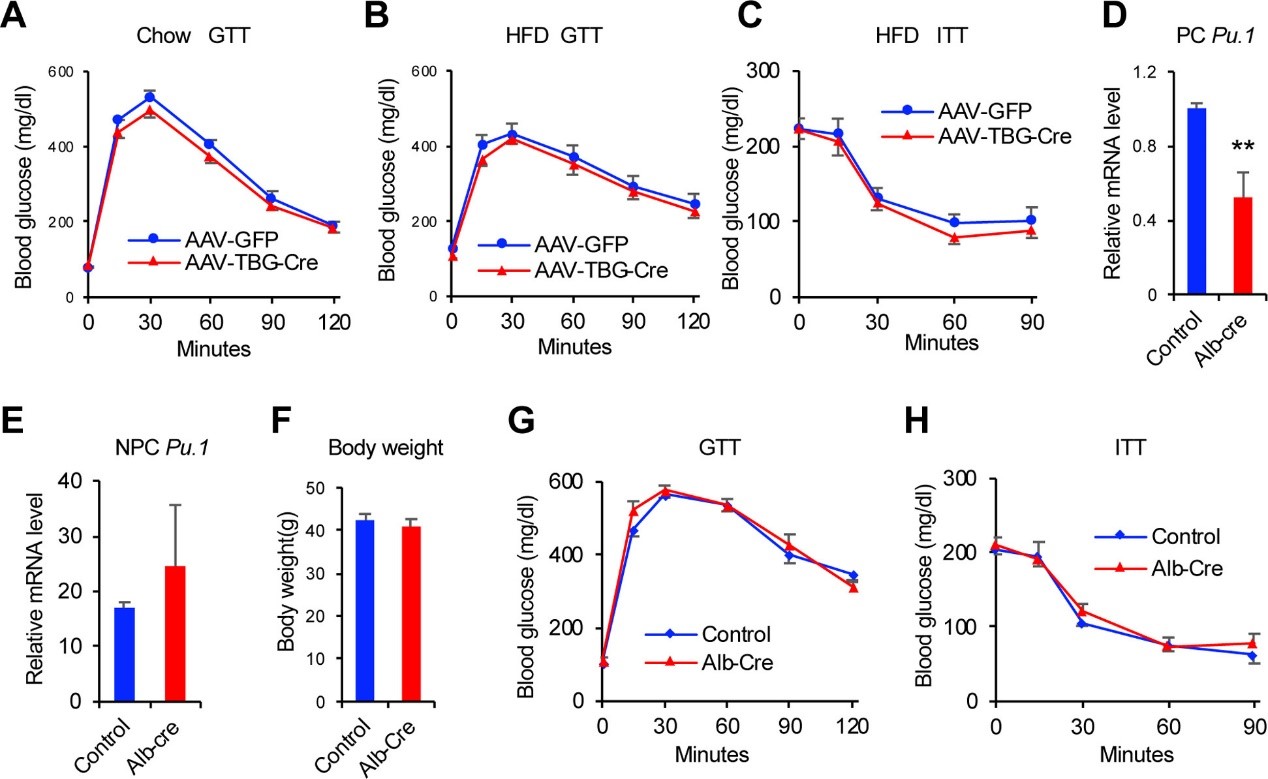
图4 肝细胞特异性敲除PU.1
地 址: 上海市园美路58号1号楼15-18楼 联系人: 徐 电 话: 021-54665263 传 真: Email:marketing@aptbiotech.com
会议邀请 | 第8届全国植物蛋白质研究大会暨首届贵阳生命科学新高地科学家论坛
(2023-07-07T14:37 浏览数:13321)
项目文章Cell(IF 64.5)| 中国科技大学探索食物过敏谜团
(2023-07-07T14:22 浏览数:13555)
Gastroenterology(IF 29.4)| 基于机器学习算法开发的外泌体miRNA生物标志物用于胰腺导管腺癌早期诊断
(2023-07-05T15:54 浏览数:11176)
Cancer Letters(IF 9.7)|天津市环湖医院利用Labelfree揭示超声-替莫唑胺联合诱导胶质瘤细胞的凋亡机制
(2023-06-30T09:37 浏览数:12235)
Excel表免费下载 | 速来围观!2023年影响因子发布
(2023-06-29T09:35 浏览数:11018)
外泌体多组学创新解决方案,精准、前沿的疾病诊断生物标志物
(2023-06-28T10:20 浏览数:15095)
Immunity (IF=43.474)丨单细胞+空间联合揭示肉芽肿形成的异常淋巴发育进程
(2023-06-26T17:28 浏览数:11305)
专家齐聚 亮点回顾 | 2023年海口·中医药创新多组学研究论坛圆满落幕
(2023-06-25T10:10 浏览数:15764)
项目文章Plant J(IF 7)| 杭州师范大学王慧中团队通过空间代谢+单细胞测序等揭示红豆杉幼茎细胞特异的紫杉烷合成调控模式
(2023-06-25T09:42 浏览数:13443)
项目文章Gut Microbes(IF 9.434)| 肠道微生物竟是导致胆囊切除术后患者腹泻的元凶?
(2023-06-14T16:35 浏览数:10857)
上海中科新生命生物科技有限公司
商家主页
相关咨询


